O metabolismo das células aeróbias depende do recebimento contínuo de oxigênio, usado na oxidação de nutrientes. Por outro lado, o CO2 resultante dessa oxidação deve ser removido constantemente.
As novas conformações assumidas pela molécula de hemoglobina devido às sucessivas ligações com o oxigênio têm afinidades crescentes pelo oxigênio, de tal maneira que a ligação da quarta molécula de oxigênio é 300 vezes mais eficiente do que a ligação da primeira. A esse fenômeno dá-se o nome de cooperatividade.
A alta afinidade por oxigênio, mesmo em baixa pO2, permite que a mioglobina desempenhe eficientemente a função de reservatório de oxigênio nos músculos de mamíferos, onde é encontrada em abundância.
A mioglobina tem afinidade por oxigênio maior que a hemoglobina em qualquer pO2, o que permite que ele seja transferido do sangue para o músculo, onde fica associado à mioglobina e pode ser utilizado pelas mitocôndrias das células musculares.
Nos organismos em que essas trocas não podem ser feitas diretamente com o meio por simples difusão, de modo eficiente, existem sistemas especializados incumbidos dessa função. Este é o caso dos organismos pluricelulares complexos, como os vertebrados, nos quais esse papel é exercido por elementos componentes do sangue (hemoglobina presente nas hemácias).
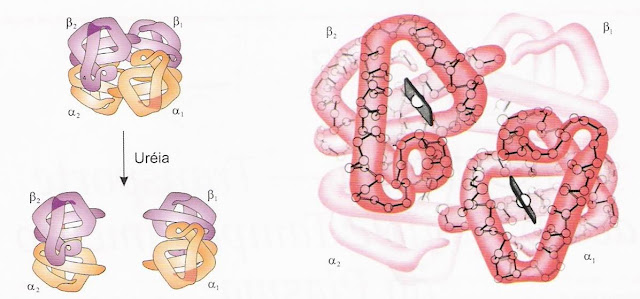
Estrutura da hemoglobina
As quatro cadeias da hemoglobina associam-se em dímeros
 |
| Ligações não covalentes |
Mecanismo de ligação do oxigênio à hemoglobina
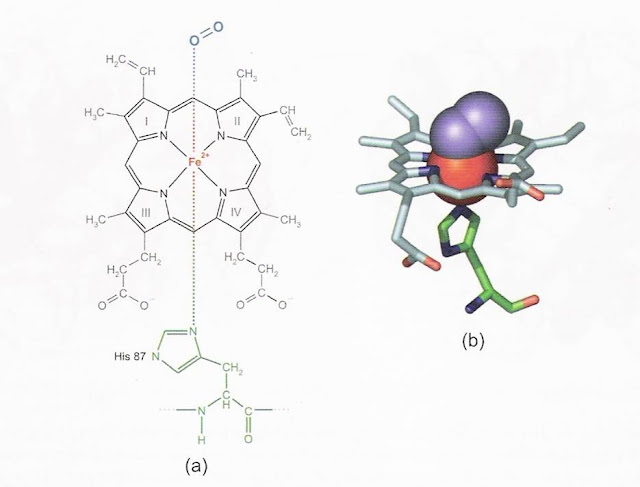 |
| O grupo prostético heme é o sítio de ligação do oxigênio |
O grupo heme, em cada subunidade, localiza-se dentro de uma cavidade hidrofóbica, delimitada, sobretudo por aminoácidos apolares, que estabelecem interações hidrofóbicas com o anel porfirínico. Este ambiente apolar torna possível a ligação do oxigênio ao ferro (Fe2+), sem que ele seja oxidado ao estado férrico (Fe3+).
Ao sítio de ligação do ferro com oxigênio, aparentemente tão específico, podem ligar-se, ainda, outras moléculas pequenas, como CO (monóxido de carbono) e H2S (gás sulfídrico), com afinidade ainda maior que o oxigênio, que é, portanto, excluído.
Uma molécula de hemoglobina totalmente oxigenada contém, portanto, quatro moléculas de O2 e é denominada oxiemoglobina (oxi-Hb ou HbO2), em contraposição à forma desprovida de oxigênio, chamada desoxiemoglobina (desoxiHb ou Hb). A ligação do oxigênio ao grupo heme altera a cor da hemoglobina, que passa de azulada (sangue venoso) a vermelha (sangue arterial).
A ligação do oxigênio ao Fe2+ do grupo heme provoca o deslocamento do ferro para o plano do anel porfirínico, que se torna mais achatado, deslocando a histidina proximal e iniciando uma série de alterações estruturais na hemoglobina.
Uma molécula de hemoglobina totalmente oxigenada contém, portanto, quatro moléculas de O2 e é denominada oxiemoglobina (oxi-Hb ou HbO2), em contraposição à forma desprovida de oxigênio, chamada desoxiemoglobina (desoxiHb ou Hb). A ligação do oxigênio ao grupo heme altera a cor da hemoglobina, que passa de azulada (sangue venoso) a vermelha (sangue arterial).
A ligação do oxigênio ao Fe2+ do grupo heme provoca o deslocamento do ferro para o plano do anel porfirínico, que se torna mais achatado, deslocando a histidina proximal e iniciando uma série de alterações estruturais na hemoglobina.
O pequeno deslocamento do ferro (cerca de 0,5 Å (angstron=10-10m)), causado pela ligação do oxigênio ao grupo heme de uma subunidade, dispara uma seqüência de eventos mecanicamente transmitidos, que alteram a estrutura quaternária da hemoglobina.
No caso da mioglobina, por exemplo, que apresenta uma única cadeia polipeptídica e um único grupo heme, a cooperatividade, evidentemente, não é observada.