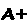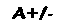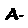Os íons H+ (como acontece com o BPG) ligam-se preferencialmente à desoxi-Hb, que passa, então, a constituir a forma predominante, o que corresponde a uma diminuição na afinidade da hemoglobina por oxigênio. A associação preferencial dos íons H+ à desoxi-Hb evidencia que esta forma da proteína é uma base de Brönsted mais forte do que a forma oxigenada.
Esta diferença de comportamento ácido-base é conseqüência da movimentação das subunidades da hemoglobina, devido à associação/dissociação de oxigênio, que modifica a relação espacial entre determinados aminoácidos e, conseqüentemente, os valores de pKa de seus grupos ionizáveis.
Esta diferença de comportamento ácido-base é conseqüência da movimentação das subunidades da hemoglobina, devido à associação/dissociação de oxigênio, que modifica a relação espacial entre determinados aminoácidos e, conseqüentemente, os valores de pKa de seus grupos ionizáveis.
Uma alteração importante refere-se à posição relativa de dois resíduos de aminoácidos das subunidades β, His146 e Asp94, localizados nas interfaces entre os dímeros: quando a hemoglobina é desoxigenada, estes resíduos ficam mais próximos do que eram na oxi-Hb.
Esta aproximação promove a formação de uma ligação iônica entre o radical carboxila (carga negativa) do Asp94 e o grupo imidazólico (carga positiva) da His146, que é uma das ligações existentes somente na desoxi-Hb.
A interação iônica estabiliza a forma protonada da His146, tornando mais "difícil" a dissociação de seu próton: o valor do pKa do grupo imidazólico passa de 6,5 a 8,0 aproximadamente, ou seja, converte-se em uma base de Brönsted mais forte, ficando protonada no pH do sangue venoso (7,2).
Quando a hemoglobina é oxigenada, há um distanciamento entre His146 e Asp94 e a interação entre eles não mais se estabelece; o valor do pKa da His146 cai para 6,5, ou seja, converte-se em um ácido de Brönsted mais forte e, no pH do sangue arterial (7,4), fica predominantemente desprotonado.
Outros resíduos de aminoácidos comportam-se como a His146: sofrem alteração no valor de pKa, devido a mudanças no seu microambiente, perdendo prótons quando a hemoglobina é oxigenada e ganhando prótons quando ela é desoxigenada.
Em resumo, a conversão de oxi-Hb em desoxi-Hb é acompanhada por captação de prótons, e a sua oxigenação, por liberação de prótons.
A influência do pH sobre a oxigenação da hemoglobina tem grande importância fisiológica, porque, nos organismos, um decréscimo no pH (produção de CO2 pelo metabolismo) está sempre associado a uma maior demanda de oxigênio.
Outros resíduos de aminoácidos comportam-se como a His146: sofrem alteração no valor de pKa, devido a mudanças no seu microambiente, perdendo prótons quando a hemoglobina é oxigenada e ganhando prótons quando ela é desoxigenada.
Em resumo, a conversão de oxi-Hb em desoxi-Hb é acompanhada por captação de prótons, e a sua oxigenação, por liberação de prótons.
A influência do pH sobre a oxigenação da hemoglobina tem grande importância fisiológica, porque, nos organismos, um decréscimo no pH (produção de CO2 pelo metabolismo) está sempre associado a uma maior demanda de oxigênio.
O conjunto dos fenômenos relacionados com o aumento do caráter básico da hemoglobina causado por sua desoxigenação e o aumento do caráter ácido quando ela se liga ao oxigênio constitui o efeito Bohr, que pode ser representado pelas equações:
A análise destas equações revela o papel fundamental desempenhado pela hemoglobina na manutenção do pH plasmático: à medida que a pO2 diminui e a concentração de H+ aumenta, a hemoglobina libera O2 e capta H+. Quando a pO2 aumenta e a concentração de H+ diminui, ela se liga a O2 e libera H+. Estas são as condições encontradas nos tecidos e nos alvéolos pulmonares, respectivamente.